Физико-химические основы процесса горения
Пожар представляет собой неконтролируемое горение, развивающееся во времени и пространстве, опасное для людей и наносящее материальный ущерб.
Опасными для людей факторами пожара являются открытый огонь, искры, повышенная температура, токсичные продукты горения, дым, уменьшение содержания кислорода, обрушения зданий или установок.
Горение — быстро протекающая физико-химическая реакция, сопровождающаяся выделением теплоты и дыма, появлением пламени или тлением. В обычных условиях горение представляет собой процесс окисления или соединения горючего вещества с кислородом воздуха. Однако некоторые вещества (например сжатый ацетилен, хлористый азот, озон) могут взрываться и без кислорода с образованием теплоты и пламени. Следовательно, горение может явиться результатом реакций не только соединения, но и разложения. Известно также, что водород и многие металлы могут гореть в, атмосфере хлора, медь — в парах серы, магний — в двуокиси-углерода и т. д.
Наиболее опасно горение, возникающее при окислении горючего вещества кислородом воздуха. При этом необходимо наличие источника зажигания, способного сообщить горючей системе необходимое количество энергии. Наиболее распространенными источниками зажигания являются: искры, появляющиеся при неисправности электрооборудования, ударе металлических тел, сварке, кузнечных работах; теплота, возникающая в результате трения; технологические нагревательные устройства; аппараты огневого действия; теплота адиабатического сжатия; искровые разрядц статического электричества; перегрев электрических контактов; химические реакции, протекающие с выделением теплоты.
Температура нагрева этих источников различна. Так, искра, возникающая при ударе металлических тел, может иметь температуру до 1900°С, пламя спички около. 800°С, ведущий барабан ленточного конвейера при пробуксовке — до 600°С, а в накале электрического разряда температура доходит до 10 000°С, при этом почти мгновенно завершаются химические реакции.
Горение может быть полным и неполным. При полном горении, протекающем при избытке кислорода, продуктами реакции являются диоксид углерода, вода, азот, сернистый ангидрид. Неполное горение происходит при недостатке кислорода, продуктами горения в этом случае являются ядовитые и горючие вещества — оксид углерода, спирты, кетоны, альдегиды и др. Для полного сгорания горючего вещества необходимо определенное количество воздуха: 1 кг древесины — 4,18, торфа — 5,8, пропана — 23,8 м3.
Процесс горения можно представить себе следующим образом. Холодная горючая среда при введении теплового импульса разогревается, происходит интенсивное окисление горючей среды кислородом и дополнительное выделение теплоты. Это, в свою очередь, приводит к разогреву соседнего слоя горючего вещества, в котором также протекает интенсивная химическая реакция. При таком послойном сгорании горючего вещества происходит перемещение зоны горения; скорость этого перемещения определяет интенсивность процесса горения и является его важнейшей характеристикой. Процесс послойного разогрева, окисления и сгорания продолжается до тех пор, пока не исчерпается весь объем горючего вещества.
Узкую зону, в которой подогревается вещество и протекает химическая реакция, называют фронтом пламени.
Горючие системы могут быть химически однородными и неоднородными. Химически однородные системы — это смеси горючих газов, паров или пылей с воздухом, в которых равномерно перемешаны горючее вещество и воздух. Горение таких систем называется гомогенным. В химически неоднородных системах горючее вещество и воздух не перемешаны и имеют границу раздела. Это чаще всего твердые горючие материалы и их горение называют гетерогенным.
Полное время сгорания горючей смеси тг складывается из времени, необходимого для возникновения контакта между горючим веществом и кислородом τк, и времени, в течение которого происходит сама химическая, реакция окисления τx
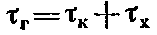
В зависимости от соотношения этих двух слагаемых различают горение диффузионное и кинетическое. При горении твердых горючих веществ время, необходимое для проникновения (диффузии) кислорода к поверхности вещества, гораздо больше времени химической реакции, поэтому общая скорость горения полностью определяется скоростью диффузии кислорода к горючему веществу. Горение таких веществ наиболее часто встречается на пожарах и называется диффузионным. Горение, скорость которого определяется скоростью химической реакции, называют кинетическим. Этот вид горения характерен для однородных горючих систем.
Различают калориметрическую, теоретическую и действительную температуру горения.
Калориметрической температурой горения называют температуру, до которой нагреваются продукты полного сгорания, если вся выделившаяся теплота расходуется па их нагревание, количество воздуха равно теоретически необходимому, происходит полное сгорание веществ и начальная температура равна 0°С. Потери теплоты при этом принимают равными нулю. Если начальная температура горючего вещества и воздуха равна 0°С, то калориметрическая температура горения
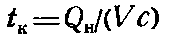
где Qн — низшая теплота сгорания горючего вещества, ккал/кг; V — объем продуктов сгорания, м3/кг; с — средняя объемная теплоемкость продуктов сгорания, ккал/м3·град.
Следовательно, калориметрическая температура горения зависит только от свойств горючего вещества и не зависит от его количества. Теоретическая температура горения учитывает потери теплоты при горении на диссоциацию. Калориметрическая температура горения является наибольшей для горючего вещества и применяется для качественной оценки. В действительности при горении всегда имеются потери теплоты на излучение, нагрев избыточного воздуха и окружающей среды.
Действительная температура горения — это температура пожара. Различают температуру внутреннего и наружного пожара. Температура наружного пожара — температура пламени, а внутреннего — температура дыма в помещении. Действительные температуры, развивающиеся при пожаре, вследствие потерь теплоты в окружающую среду, нагревания продуктов сгорания и конструкций
всегда меньше теоретических на 30...50%. Например, теоретическая температура горения бензина 1730°С, а действительная 1400°С.
Смесь горючих паров и газов с окислителем способна гореть только при определенном содержании в ней горючего.
Наименьшую концентрацию горючего газа, при которой уже возможно горение, называют нижним концентрационным пределом воспламенения (НКПВ). Наибольшую концентрацию, при которой еще возможно горение, называют верхним концентрационным пределом воспламенения (ВКПВ). Область концентраций, лежащую внутри этих границ, называют областью воспламенения. Воспламенение — это возгорание (начало горения), сопровождающееся появлением пламени. Это устойчивое длительное горение, не прекращающееся и после удаления источника зажигания. Значения нижнего и верхнего пределов воспламенения зависят от свойств газа, пара и пыли воздушных смесей, содержания в горючей смеси инертных компонентов. Добавление в горючую смесь инертных газов сужает область воспламенения и в конце концов делает ее негорючей. Значительно сужают пределы воспламенения некоторые примеси, замедляющие реакции горения. Наиболее активными из них являются галоидированные углеводороды. Оба отмеченных свойства используют для прекращения горения. Понижение давления смеси ниже атмосферного также сужает область воспламенения, и при определенном давлении смесь становится негорючей. Увеличение давления горючей смеси расширяет область воспламенения, но, как правило, незначительно. Повышение температуры горючей смеси расширяет область воспламенения. На концентрационные пределы воспламенения влияет также мощность источника зажигания.
Различают не только концентрационные, но и температурные пределы воспламенения.
Температурными пределами воспламенения паров в воздухе называются такие температуры горючего вещества, при которых его насыщенные пары образуют концентрации, соответствующие нижнему или верхнему концентрационному пределу воспламенения. Температурой воспламенения называют ту наименьшую температуру, при которой вещество загорается или начинает тлеть и продолжает гореть или тлеть после удаления источника воспламенения. Температура воспламенения характеризует способность вещества к самостоятельному горению. Если температура воспламенения у вещества отсутствует, то его относят к трудногорючим или негорючим.
Ускорение реакции окисления под действием температуры приводит к самовоспламенению. В отличие от процесса возгорания, при котором загорается только ограниченная часть объема — поверхность, самовоспламенение происходит во всем объеме вещества. Под температурой самовоспламенения понимают наинизшую температуру, до которой надо нагреть вещество, чтобы в результате дальнейшего самоокисления оно воспламенилось. Самовоспламенение возможно только в том случае, если количество теплоты, выделяемое в процессе окисления, превысит отдачу теплоты в окружающую среду.
Температура самовоспламенения не является постоянной для вещества, так как она в значительной степени зависит от условий ее определения. Для получения сравнительных данных испытательная аппаратура и методика определения температуры самовоспламенения газов и паров стандартизована (ГОСТ 13920—68). Определяемую стандартным методом наименьшую температуру, до которой должна быть равномерно нагрета смесь газов и паров с воздухом для того, чтобы она воспламенилась без внесения в нее внешнего источника зажигания, называют стандартной температурой самовоспламенения.
Разновидность самовоспламенения — самовозгорание, т. е. горение в результате самонагревания без воздействия источника зажигания. Различие между самовоспламенением и самовозгоранием заключается в величине температуры. Самовозгорание происходит при температуре окружающего воздуха, а для самовоспламенения необходимо нагреть вещество извне.


Полезная информация:
Опасными для людей факторами пожара являются открытый огонь, искры, повышенная температура, токсичные продукты горения, дым, уменьшение содержания кислорода, обрушения зданий или установок.
Горение — быстро протекающая физико-химическая реакция, сопровождающаяся выделением теплоты и дыма, появлением пламени или тлением. В обычных условиях горение представляет собой процесс окисления или соединения горючего вещества с кислородом воздуха. Однако некоторые вещества (например сжатый ацетилен, хлористый азот, озон) могут взрываться и без кислорода с образованием теплоты и пламени. Следовательно, горение может явиться результатом реакций не только соединения, но и разложения. Известно также, что водород и многие металлы могут гореть в, атмосфере хлора, медь — в парах серы, магний — в двуокиси-углерода и т. д.
Наиболее опасно горение, возникающее при окислении горючего вещества кислородом воздуха. При этом необходимо наличие источника зажигания, способного сообщить горючей системе необходимое количество энергии. Наиболее распространенными источниками зажигания являются: искры, появляющиеся при неисправности электрооборудования, ударе металлических тел, сварке, кузнечных работах; теплота, возникающая в результате трения; технологические нагревательные устройства; аппараты огневого действия; теплота адиабатического сжатия; искровые разрядц статического электричества; перегрев электрических контактов; химические реакции, протекающие с выделением теплоты.
Температура нагрева этих источников различна. Так, искра, возникающая при ударе металлических тел, может иметь температуру до 1900°С, пламя спички около. 800°С, ведущий барабан ленточного конвейера при пробуксовке — до 600°С, а в накале электрического разряда температура доходит до 10 000°С, при этом почти мгновенно завершаются химические реакции.
Горение может быть полным и неполным. При полном горении, протекающем при избытке кислорода, продуктами реакции являются диоксид углерода, вода, азот, сернистый ангидрид. Неполное горение происходит при недостатке кислорода, продуктами горения в этом случае являются ядовитые и горючие вещества — оксид углерода, спирты, кетоны, альдегиды и др. Для полного сгорания горючего вещества необходимо определенное количество воздуха: 1 кг древесины — 4,18, торфа — 5,8, пропана — 23,8 м3.
Процесс горения можно представить себе следующим образом. Холодная горючая среда при введении теплового импульса разогревается, происходит интенсивное окисление горючей среды кислородом и дополнительное выделение теплоты. Это, в свою очередь, приводит к разогреву соседнего слоя горючего вещества, в котором также протекает интенсивная химическая реакция. При таком послойном сгорании горючего вещества происходит перемещение зоны горения; скорость этого перемещения определяет интенсивность процесса горения и является его важнейшей характеристикой. Процесс послойного разогрева, окисления и сгорания продолжается до тех пор, пока не исчерпается весь объем горючего вещества.
Узкую зону, в которой подогревается вещество и протекает химическая реакция, называют фронтом пламени.
Горючие системы могут быть химически однородными и неоднородными. Химически однородные системы — это смеси горючих газов, паров или пылей с воздухом, в которых равномерно перемешаны горючее вещество и воздух. Горение таких систем называется гомогенным. В химически неоднородных системах горючее вещество и воздух не перемешаны и имеют границу раздела. Это чаще всего твердые горючие материалы и их горение называют гетерогенным.
Полное время сгорания горючей смеси тг складывается из времени, необходимого для возникновения контакта между горючим веществом и кислородом τк, и времени, в течение которого происходит сама химическая, реакция окисления τx
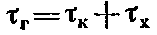
В зависимости от соотношения этих двух слагаемых различают горение диффузионное и кинетическое. При горении твердых горючих веществ время, необходимое для проникновения (диффузии) кислорода к поверхности вещества, гораздо больше времени химической реакции, поэтому общая скорость горения полностью определяется скоростью диффузии кислорода к горючему веществу. Горение таких веществ наиболее часто встречается на пожарах и называется диффузионным. Горение, скорость которого определяется скоростью химической реакции, называют кинетическим. Этот вид горения характерен для однородных горючих систем.
Различают калориметрическую, теоретическую и действительную температуру горения.
Калориметрической температурой горения называют температуру, до которой нагреваются продукты полного сгорания, если вся выделившаяся теплота расходуется па их нагревание, количество воздуха равно теоретически необходимому, происходит полное сгорание веществ и начальная температура равна 0°С. Потери теплоты при этом принимают равными нулю. Если начальная температура горючего вещества и воздуха равна 0°С, то калориметрическая температура горения
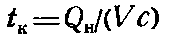
где Qн — низшая теплота сгорания горючего вещества, ккал/кг; V — объем продуктов сгорания, м3/кг; с — средняя объемная теплоемкость продуктов сгорания, ккал/м3·град.
Следовательно, калориметрическая температура горения зависит только от свойств горючего вещества и не зависит от его количества. Теоретическая температура горения учитывает потери теплоты при горении на диссоциацию. Калориметрическая температура горения является наибольшей для горючего вещества и применяется для качественной оценки. В действительности при горении всегда имеются потери теплоты на излучение, нагрев избыточного воздуха и окружающей среды.
Действительная температура горения — это температура пожара. Различают температуру внутреннего и наружного пожара. Температура наружного пожара — температура пламени, а внутреннего — температура дыма в помещении. Действительные температуры, развивающиеся при пожаре, вследствие потерь теплоты в окружающую среду, нагревания продуктов сгорания и конструкций
всегда меньше теоретических на 30...50%. Например, теоретическая температура горения бензина 1730°С, а действительная 1400°С.
Смесь горючих паров и газов с окислителем способна гореть только при определенном содержании в ней горючего.
Наименьшую концентрацию горючего газа, при которой уже возможно горение, называют нижним концентрационным пределом воспламенения (НКПВ). Наибольшую концентрацию, при которой еще возможно горение, называют верхним концентрационным пределом воспламенения (ВКПВ). Область концентраций, лежащую внутри этих границ, называют областью воспламенения. Воспламенение — это возгорание (начало горения), сопровождающееся появлением пламени. Это устойчивое длительное горение, не прекращающееся и после удаления источника зажигания. Значения нижнего и верхнего пределов воспламенения зависят от свойств газа, пара и пыли воздушных смесей, содержания в горючей смеси инертных компонентов. Добавление в горючую смесь инертных газов сужает область воспламенения и в конце концов делает ее негорючей. Значительно сужают пределы воспламенения некоторые примеси, замедляющие реакции горения. Наиболее активными из них являются галоидированные углеводороды. Оба отмеченных свойства используют для прекращения горения. Понижение давления смеси ниже атмосферного также сужает область воспламенения, и при определенном давлении смесь становится негорючей. Увеличение давления горючей смеси расширяет область воспламенения, но, как правило, незначительно. Повышение температуры горючей смеси расширяет область воспламенения. На концентрационные пределы воспламенения влияет также мощность источника зажигания.
Различают не только концентрационные, но и температурные пределы воспламенения.
Температурными пределами воспламенения паров в воздухе называются такие температуры горючего вещества, при которых его насыщенные пары образуют концентрации, соответствующие нижнему или верхнему концентрационному пределу воспламенения. Температурой воспламенения называют ту наименьшую температуру, при которой вещество загорается или начинает тлеть и продолжает гореть или тлеть после удаления источника воспламенения. Температура воспламенения характеризует способность вещества к самостоятельному горению. Если температура воспламенения у вещества отсутствует, то его относят к трудногорючим или негорючим.
Ускорение реакции окисления под действием температуры приводит к самовоспламенению. В отличие от процесса возгорания, при котором загорается только ограниченная часть объема — поверхность, самовоспламенение происходит во всем объеме вещества. Под температурой самовоспламенения понимают наинизшую температуру, до которой надо нагреть вещество, чтобы в результате дальнейшего самоокисления оно воспламенилось. Самовоспламенение возможно только в том случае, если количество теплоты, выделяемое в процессе окисления, превысит отдачу теплоты в окружающую среду.
Температура самовоспламенения не является постоянной для вещества, так как она в значительной степени зависит от условий ее определения. Для получения сравнительных данных испытательная аппаратура и методика определения температуры самовоспламенения газов и паров стандартизована (ГОСТ 13920—68). Определяемую стандартным методом наименьшую температуру, до которой должна быть равномерно нагрета смесь газов и паров с воздухом для того, чтобы она воспламенилась без внесения в нее внешнего источника зажигания, называют стандартной температурой самовоспламенения.
Разновидность самовоспламенения — самовозгорание, т. е. горение в результате самонагревания без воздействия источника зажигания. Различие между самовоспламенением и самовозгоранием заключается в величине температуры. Самовозгорание происходит при температуре окружающего воздуха, а для самовоспламенения необходимо нагреть вещество извне.


Полезная информация: